La Federación Latinoamericana de la Industria Farmacéutica (FIFARMA) publicó hace unos días el estudio Patients W.A.I.T Inductor 2022 Survey, donde se analiza la disponibilidad y el tiempo de acceso a medicamentos innovadores en ocho países de Latinoamérica: Argentina, Brasil, Chile, Colombia, Costa Rica, Ecuador, México y Perú.
El informe revisa el tiempo que tardan en llegar a las y los pacientes 185 medicamentos oncológicos y para enfermedades huérfanas, desde que se les otorga autorización de la Administración de Alimentos y Medicamentos de E.E.U.U (FDA), hasta que las terapias innovadoras están disponibles para las personas de la región.
¿Qué encontró el estudio?
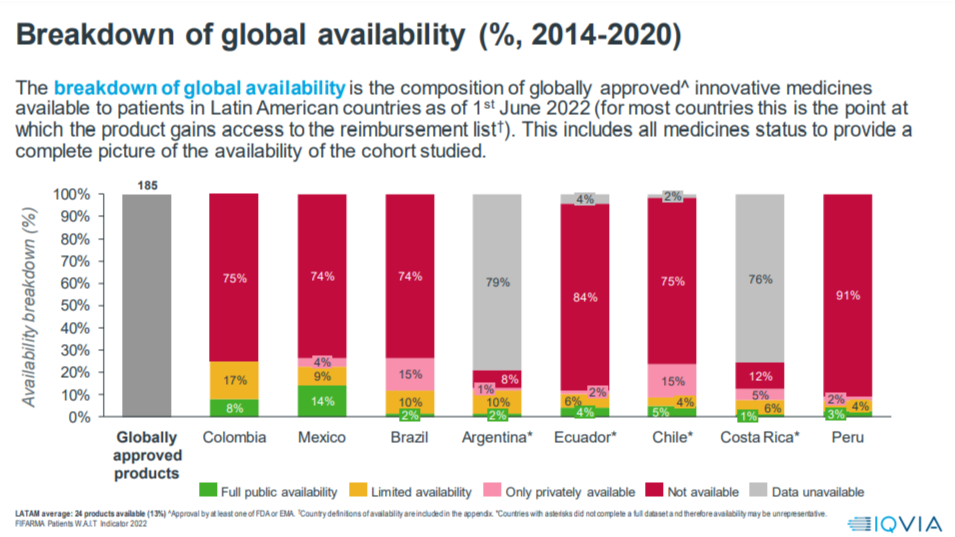
Es muy bajo el acceso de los pacientes a los medicamentos innovadores aprobados a nivel mundial para cáncer y enfermedades huérfanas, con una tasa media del 13%.
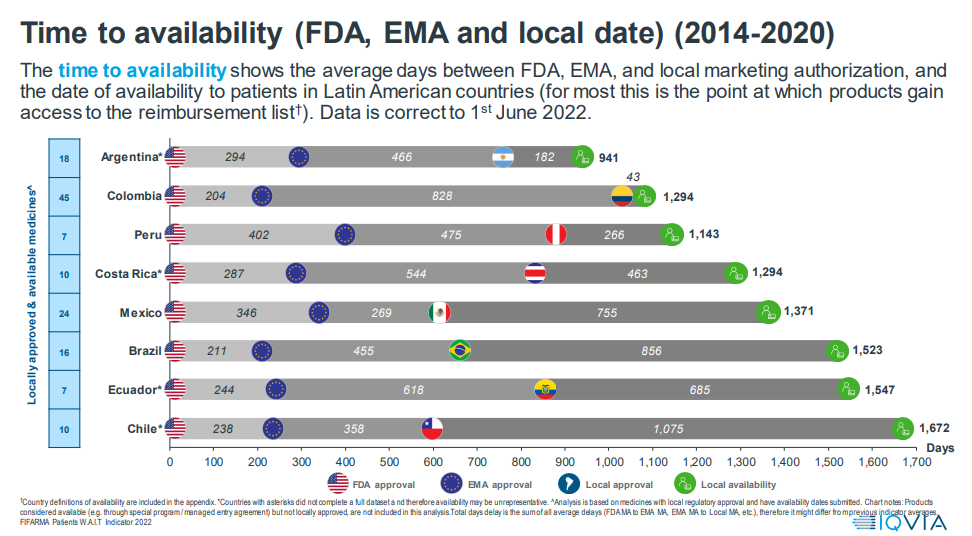
Los días que transcurren entre la autorización de una terapia (oncología y enfermedades huérfanas) por parte de la FDA o la European Medicines Agency (EMA), la autorización de comercialización en cada país y la fecha de disponibilidad para los pacientes, va desde los 941 días en Argentina, hasta los 1672 días en Chile. Mientras tanto, en México el tiempo es de 1371 días.
Este estudio se basa en el reporte que realiza la Federación Europea de Industrias y Asociaciones Farmacéuticas (EFPIA) desde el 2004 y se complementa con el estudio que realizamos en México llamado Tiempos para la disponibilidad de insumos para la salud en el
Sistema Nacional de Salud 2015-2020.
La importancia de estos análisis radica en que permiten tener información sobre el tiempo que le toma a los y las pacientes acceder a medicamentos que pueden salvar sus vidas o cambiar por completo el curso de su enfermedad, y por supuesto, proponer iniciativas y soluciones conjuntas que beneficien a los pacientes.
En este enlace pueden encontrar el informe completo de FIFARMA y explorar todos los hallazgos.




