En los últimos 23 meses no se ha entregado registro sanitario a ningún medicamento innovador, lo que deriva en ausencia de opciones terapéuticas para los y las pacientes.
El acceso a medicamentos innovadores es fundamental para mejorar la salud de la población, reducir el tiempo de hospitalización, disminuir la morbilidad, la mortalidad y mejorar la calidad de vida de las personas.
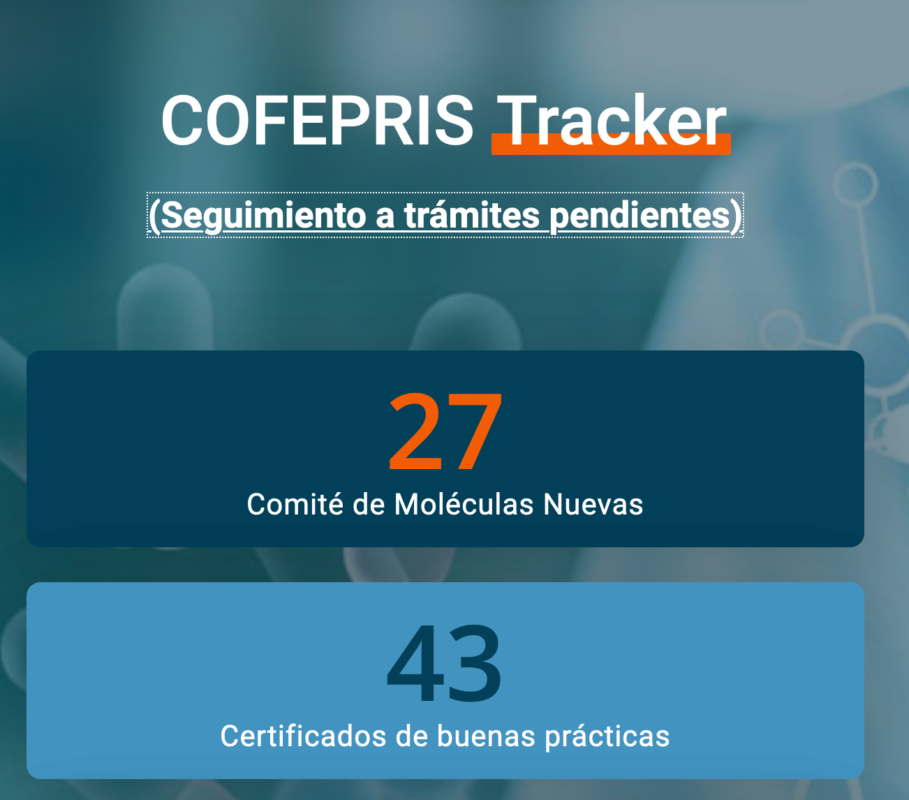
Actualmente hay 27 moléculas nuevas pendientes de respuesta por parte del Comité de Moléculas de la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris), de acuerdo información proporcionada por los socios de la Asociación Mexicana de Industrias de Investigación Farmacéutica (AMIIF). 20 de esas moléculas ya han sido aprobadas por agencias regulatorias de referencia.
Mientras que entre 2017 y 2018 la Administración de Medicamentos y Alimentos de Estados Unidos aprobó 33 productos innovadores en 240 días, la Cofepris solo aprobó 13 en 280 días, según el Center for Innovation in Regulatory Science.
En tanto, hay 150 permisos de importación pendientes de liberación por parte de las autoridades, lo que potencialmente impacta el proceso de producción y entrega de un medicamento o terapia.
Un permiso de importación hace la diferencia entre el abasto oportuno y el desabasto de un medicamento o terapia.
Esta información es parte del monitoreo que hace AMIIF a través de la plataforma COFEPRIS Tracker, cuyo objetivo es dar seguimiento a algunos de los trámites regulatorios que deben realizar medicamentos y terapias innovadoras en México para garantizar su calidad, seguridad y eficacia.
En el sitio se da seguimiento a cinco trámites clave: Comité de moléculas nuevas, certificados de buenas prácticas, modificaciones a las condiciones de registro, prórrogas de permiso sanitario y permisos de importación. Y se reportan los trámites atrasados, esto es, que ya vencieron el tiempo legal establecido para su resolución o liberación.
Nuestra preocupación por estos “trámites” no es un preocupación burocrática. Detrás de cada uno de estos procesos pendientes hay una persona que no puede recibir el medicamento innovador que necesita para mejorar su calidad de vida; una persona que no puede recibir su tratamiento porque el registro sanitario no ha sido renovado o una persona que no puede seguir con su terapia porque el permiso de importación para traer, por ejemplo, el API que se necesita para fabricarlo, no ha sido liberado.
La información, que se actualiza mensualmente, es proporcionada por los socios de AMIIF, y la asociación únicamente recopila, organiza y hace públicos los datos.
Toda la información sobre requisitos por parte de la autoridad se basa en fuentes oficiales, y la información académica o de fuentes no gubernamentales se encuentra debidamente documentada, con sus referencias, para facilitar su consulta.
AMIIF está convencida de que la regulación del sector farmacéutico debe ser de interés de la ciudadanía y no solo de los solicitantes, pues de su cumplimiento depende la calidad y seguridad de medicamentos e insumos para la salud.
Aquí pueden navegar el sitio.