El 7 de enero de 2022. Cofepris otorga la autorización de emergencia al primer tratamiento antiviral oral contra la covid-19.
Vacunas autorizadas en México
Actualmente hay diez vacunas autorizadas para uso de emergencia por la Cofepris (México). Aquí puede consultarse el estatus regulatorio de estas vacunas.
| Pfizer – BioNTech |
|
| AstraZeneca – Oxford | |
| Sputnik V |
|
| Sinovac |
|
| CanSino |
|
| Covaxin |
|
| Johnson & Johnson |
|
| Moderna |
|
| Sinopharma |
|
***
Vacunas aprobadas (full approval) a nivel global
| Pfizer – BioNTech |
|
Al 2 mayo , de acuerdo con la Universidad McGill, hay 38 vacunas aprobadas, bajo distintas especificaciones sobre su uso, por al menos un país / agencia regulatoria.
***
Vacunas con autorización de emergencia por parte de la OMS:
31 diciembre 2020: Pfizer – BioNTech
15 febrero 2021: Dos versiones de la vacuna de AstraZeneca/Oxford
15 febrero 2021: La vacuna del Serum Institute de la India (Covidshield)
30 abril 2021: Moderna
12 mayo 2021: Johnson & Johnson
7 mayo 2021: Sinopharm
1 junio 2021: Sinovac
3 noviembre 2021: Covaxin
17 diciembre 2021: Covovax
20 diciembre 2021: Novavax
***
De acuerdo con el último reporte de la OMS (21 diciembre 2021): hay 331 vacunas en desarrollo para COVID-19, 137 en evaluación clínica y 39 de estas en fase III y 10 en fase IV.
(Descarga la infografía de La carrera colaborativa para encontrar una solución para la Covid-19, en datos)
Línea de tiempo de las vacunas en desarrollo
-
- El 2 de noviembre, la OMS reportaba 322 vacunas en desarrollo, 128 en evaluación clínica
- El 17 de octubre, la OMS reportaba 320 vacunas en desarrollo. 126 en evaluación clínica.
- El 17 septiembre, la OMS reportaba 311 vacunas en desarrollo. 117 en evaluación clínica.
- El 17 agosto, la OMS reportaba 295 vacunas en desarrollo. 112 en evaluación clínica.
- El 31 julio, la OMS reportaba 295 vacunas en desarrollo. 118 en evaluación clínica.
- El 13 julio, la OMS reportaba 292 vacunas en desarrollo. 108 en evaluación clínica.
- El 25 junio, la OMS reportaba 290 vacunas en desarrollo. 106 en evaluación clínica.
- El 4 junio, la OMS reportaba 287 vacunas en desarrollo. 103 en evaluación clínica.
- El 28 mayo, la OMS reportaba 287 vacunas en desarrollo. 103 en evaluación clínica.
- El 4 mayo, la OMS reportaba 277 vacunas en desarrollo. 92 en evaluación clínica.
- El 20 abril, la OMS reportaba 275 vacunas en desarrollo. 92 en evaluación clínica.
- El 13 abril, la OMS reportaba 272 vacunas en desarrollo. 88 en evaluación clínica.
- El 2 abril, la OMS reportaba 273 vacunas en desarrollo. 87 en evaluación clínica.
- El 16 marzo, la OMS reportaba 264 vacunas en desarrollo. 82 en evaluación clínica.
- El 5 marzo, la OMS reportaba 261 vacunas en desarrollo. 79 en evaluación clínica.
- El 23 febrero, la OMS reportaba 255 vacunas en desarrollo. 73 en evaluación clínica.
- El 12 de febrero, la OMS reportaba 242 vacunas en desarrollo. 66 en evaluación clínica.
- El 9 de febrero, la OMS reportaba 242 vacunas en desarrollo. 63 en evaluación clínica.
- El 26 de enero, la OMS reportaba 236 vacunas en desarrollo. 63 en evaluación clínica.
- El 15 de enero, la OMS reportaba 237 vacunas en desarrollo. 64 en evaluación clínica.
- El 12 de enero, la OMS reportaba 236 vacunas en desarrollo. 63 en evaluación clínica.
- El 29 de diciembre, la OMS reportaba 232 vacunas en desarrollo. 60 en evaluación clínica.
- El 17 de diciembre, la OMS reportaba 222 vacunas en desarrollo. 56 en evaluación clínica.
- El 8 de diciembre, la OMS reportaba 214 vacunas en desarrollo. 52 en evaluación clínica.
- El 2 de diciembre, la OMS reportaba 214 vacunas en desarrollo. 51 en evaluación clínica.
- El 12 de noviembre de 2020, la OMS reportaba 212 vacunas. 48 en evaluación clínica.
- El 3 de noviembre de 2020, la OMS reportaba 202 vacunas. 47 en evaluación clínica.
- El 19 de octubre de 2020, la OMS reportaba 198 vacunas. 44 en evaluación clínica.
- El 2 de octubre de 2020, la OMS reportaba 193 vacunas. 42 en evaluación clínica.
- El 21 de septiembre de 2020, la OMS reportaba 187 vacunas. 39 en evaluación clínica.
- El 8 de septiembre de 2020, la OMS reportaba 179 vacunas. 34 en evaluación clínica.
- El 3 de septiembre de 2020, la OMS reportaba 176 vacunas. 34 en evaluación clínica.
- El 28 de agosto de 2020, la OMS reportaba 176 vacunas. 33 en evaluación clínica.
- El 25 de agosto de 2020, la OMS reportaba 173 vacunas. 31 en evaluación clínica.
- El 13 de agosto de 2020, la OMS reportaba 167 vacunas. 29 en evaluación clínica.
- El 10 de agosto de 2o2o, la OMS reportaba 167 vacunas. 28 en evaluación clínica.
- El 31 de julio de 2020, la OMS reportaba 165 vacunas. 26 en evaluación clínica.
- El 27 de julio de 2020, la OMS reportaba 164 vacunas. 25 en evaluación clínica.
- El 21 de julio de 2020, la OMS reportaba 166 vacunas. 24 en evaluación clínica.
- El 13 de julio de 2020, la OMS reportaba 160 vacunas. 23 en evaluación clínica.
- El 2 de julio de 2020, la OMS reportaba 149 vacunas. 19 en evaluación clínica.
- El 29 de junio de 2020, la OMS reportaba 149 vacunas. 17 en evaluación clínica.
- El 22 de junio de 2020, la OMS reportaba 142 vacunas. 13 en evaluación clínica.
- El 9 de junio, la OMS reportaba 136 vacunas. 10 en evaluación clínica.
- El 2 de junio, la OMS reportaba 133 vacunas. 10 en evaluación clínica.
- El 27 mayo, la OMS reportaba 131 vacunas. 10 en evaluación clínica.
- El 22 de mayo, la OMS reportaba 124 vacunas. 10 en evaluación clínica.
- El 15 de mayo, la OMS reportaba 118 vacunas en desarrollo. 8 en evaluación clínica.
- El 11 de mayo, la OMS reportaba 110 vacunas en desarrollo. 8 en evaluación clínica.
- El 5 mayo, la OMS reportaba 108 vacunas en desarrollo.
- El 11 de abril, la OMS reportaba 70 vacunas en desarrollo.
- El 23 de abril, la OMS reportó 83 vacunas en desarrollo.
***
Al 21 de diciembre 2021, Clinical Trial reporta 4816 estudios clínicos relacionados con Covid-19. 113 de ellos en México
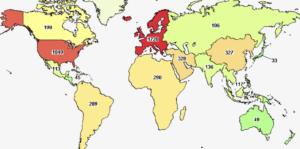
(27 de abril: 891 estudios clínicos; 4 mayo: 1134 estudios clínicos; 11 de mayo: 1269 estudios clínicos; 15 mayo: 1478 estudios clínicos; 26 mayo: 1587 estudios clínicos; 1 junio; 1736; 8 de junio: 1829; 15 de junio: 1947; 23 junio: 2071; 30 junio: 2147; 6 julio: 2182; 14 julio: 2310; 21 julio: 2416; 28 julio: 2478; 3 agosto:2562; 13 agosto: 2603; 17 agosto: 2652; 25 agosto: 2731; 1 de septiembre: 2901; 8 septiembre: 2832; 21 septiembre:2918; 6 octubre: 3028; 14 octubre: 3081; 20 octubre: 3123; 28 octubre: 3192; 4 noviembre: 3234; 17 noviembre: 3295; 2 diciembre: 3391; 8 diciembre: 3422; 20 diciembre: 3516; 4 enero: 3571; 12 enero 2021: 3638; 19 enero: 3667; 26 enero: 3710; 10 febrero: 3795; 15 febrero: 3810; 23 febrero:3861; 8 marzo: 3922; 18 marzo: 3992; 6 abril: 4105; 14 abril:4146; 21 abril: 4183; 4 mayo: 4276; 28 mayo: 4401; 7 junio: 4428; 22 junio: 4473; 29 junio: 4505; 13 julio: 4557; 2 agosto: 4577; 17 agosto: 4610; 1 septiembre: 4618; 21 septiembre: 4655; 12 octubre: 4672; 4 noviembre: 4736)
***
Pero, ¿qué son los ensayos clínicos?
Un ensayo clínico es un estudio cuidadosamente diseñado que evalúa los beneficios y los riesgos de un tratamiento o intervención médica específica.
Cada ensayo clínico está dirigido por un investigador principal. En México, la Cofepris requiere que se complete un proceso de ensayos clínicos de múltiples fases antes de decidir si el medicamento bajo investigación es seguro y efectivo para una población de pacientes más amplia. Por lo general, el número de personas que son voluntarios en los ensayos aumenta a medida que el tratamiento pasa de una fase a otra, por lo que la participación de estas personas es vital para desarrollar medicamentos innovadores. Sin su ayuda nada de esto sería posible.
En México la investigación de cualquier protocolo clínico pasa por el escrutinio de por los menos tres rigurosos comités: De ética, de investigación y de bioseguridad.
Y, con el fin de reducir al mínimo la posibilidad de causar daño, se han establecido una serie de principios éticos que deben acatar los protocolos de investigación: respeto de la autonomía, no maleficencia, beneficencia y justicia, reflejados en las guías y lineamientos nacionales e internacionales. Estos principios, por supuesto, no son limitativos, y es necesario complementarlos con otros aspectos éticos, propios de la investigación, como son la integridad científica, la confidencialidad en el manejo de información sensible o el valor social de la investigación.
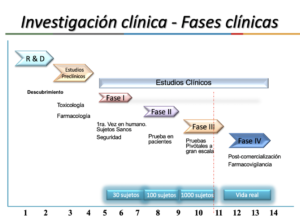
¿Cuáles son las etapas que conlleva una investigación clínica?
El proceso es técnicamente complejo y puede abarcar varios meses e incluso años (hasta 15 años de principio a fin). A grandes rasgos, se consideran tres etapas y diferentes fases.
Descubrimiento:
- Donde se debe identificar los compuestos que conforman la sustancia sobre la cual se realizará la investigación. Esto debido a que, para encontrar un compuesto óptimo, deben seleccionarse antes muchos otros, debido a que cada cambio en su estructura conlleva cambios en el efecto o actividad que genere.
- En esta etapa también se diseña el protocolo de investigación, en el que se define la muestra poblacional, es decir, las características de los candidatos clínicos o pacientes en la que se aplicará la investigación[1]. Tan sólo esta fase puede tomar hasta 8 años[2].
Pruebas No Clínicas:
- Aquí se realizan pruebas no clínicas en animales y ensayos in vitro para determinar la farmacología, el metabolismo y la seguridad de un medicamento bajo investigación antes de que pueda estudiarse en humanos.
- Luego de esto, la institución o compañía investigadora presenta una solicitud de Nuevo Fármaco bajo Investigación (IND) ante la autoridad sanitaria correspondiente: en México es la COFEPRIS, en EUA es la Administración de Alimentos y Fármacos (FDA), mientras que en Europa es la Agencia Europea de Medicamentos. La aprobación de esta solicitud permite que el medicamento bajo investigación sea estudiado en humanos[3].
Desarrollo Clínico (Fases I, II, III y IV)
Al haberse completado satisfactoriamente las etapas anteriores, es que puede iniciarse con la etapa de Desarrollo Clínico y sus Fases.
- Fase I: para estudios de seguridad iniciales, usualmente aplicado a voluntarios sanos.
- Fase II-a: para ensayos piloto, para evaluar eficacia y seguridad en la población de pacientes seleccionados ya sea con una enfermedad o con una condición a la que se desea: dar tratamiento, generar un diagnóstico u otorgar una prevención.
- Fase II-b: para ensayos controlados para evaluar eficacia y seguridad aplicado a pacientes con la enfermedad o condición.
- Fase III: para ensayos que se realizan después de que se demostró la eficacia del fármaco, pero antes del sometimiento regulatorio de autorización sanitaria[4].
- Fase IV: para estudios posteriores a la aprobación y a la comercialización del compuesto (farmacovigilancia)[5].
Las Fases de Desarrollo Clínico pueden tardar de 2 a 3 años (o más) en completarse.
Sólo si el compuesto que se ha investigado completa satisfactoriamente los estudios no clínicos y estudios clínicos, puede ser presentado ante las autoridades regulatorias para que consideren su aprobación de comercialización y uso. La revisión regulatoria puede tardar de 1 a 2 años.
¿Por qué se hace investigación clínica en México?
México cuenta con características idóneas para ser sede de investigaciones clínicas[7]:
- Un perfil demográfico que permite reclutamiento de pacientes a gran escala y con un perfil epidemiológico diverso.
- Un sistema de salud con diversidad de opciones para hacer investigación.
- Costos competitivos.
- Infraestructura hospitalaria.
- Investigadores capacitados.
- Y liderazgo regional en exportación de productos farmacéuticos.
Más aún, al ser las investigaciones clínicas procesos complejos que requieren la participación de diversos actores institucionales, en México se cuenta con toda una estructura de dichas instituciones, lo cual representa una ventaja al momento de que se desee emprender una investigación de este tipo[8]:
- Se cuenta con alrededor de 300 Comités de Ética en Investigación – (300 Registrados ante Conbioética)
- Comités de Investigación
- Comités de Bioseguridad
- Se cuenta en México con alrededor de 400 sitios de investigación
- COFEPRIS
- Existen 9 Unidades Habilitadas de Apoyo al Predictamen (UHAP)
- Organizaciones de Investigación por Contrato (CROs)
- Empresas de servicios de mensajería especializadas en estudios clínicos
- Laboratorios clínicos especializados en ensayos para estudios clínicos
- Aduanas y agentes relacionados
Adicionalmente. la investigación clínica es una actividad económica estratégica por su alto valor agregado pues genera: beneficio para la salud de las personas y fortalecimiento del sistema de salud; mayor inversión privada y atracción de inversión extranjera en investigación que se traduce en una fuente de ingresos para la hacienda pública y las instituciones que participan en el desarrollo de dichas investigaciones; facilita la transferencia de conocimiento y la incorporación de tecnología de punta[9].
***
[1] Boehringer Ingelheim México, “La investigación Clínica: el camino e la Industria, 2015”, Secretaría de Economía y ProMéxico.
[2] Dra. Gabriela Dávila PPT “¿Qué es la investigación clínica?” 2018.
[3] Dra. Gabriela Dávila PPT “¿Qué es la investigación clínica?” 2018.
[4] Boehringer Ingelheim México, “La investigación Clínica: el camino e la Industria, 2015”, apud: Secretaría de Economóa y ProMéxico.
[5] Dra. Gabriela Dávila PPT “¿Qué es la investigación clínica?” 2018.
[7] Secretaría de Economía, ProMéxico, AMIIF et. al. (S/F)
[8] ProMéxico, 2017
[9] BCI, 2017





